精准医疗使医疗技术获得了飞跃式的发展进步,多项研究成果表明,基于CRISPR/Cas9的基因疗法在遗传病治疗中有很大的应用前景。2017年,Spark公司的创新基因疗法Luxturna获得美国FDA批准上市,用于治疗患有特定遗传性眼疾的成人和儿童患者,为基因疗法研究注入了一剂强心剂。
2月18日,《自然医学》杂志同期发表了三篇基因疗法相关文章,展示了基于CRISPR/Cas9的基因疗法治疗罕见遗传病的突破性研究成果。

在杜氏肌营养不良(DMD)基因治疗长期疗效及安全性研究中,杜克大学的研究人员已经证明,基于CRISPR的基因疗法可以在一年的时间里,安全、稳定地纠正小鼠体内的DMD。研究中也观察到了免疫反应和脱靶效应,但目前的研究结果显示该疗法是安全有效的,后续仍需进行仔细地监测验证研究。接下来,我们重点了解一下这项研究。
该研究由杜克大学Charles Gersbach教授领导完成,其研究团队自2009年起就致力于DMD的基因疗法研究开发。DMD由抗肌萎缩蛋白(Dystrophin)的编码基因突变导致。如果编码抗肌萎缩蛋白的一个或多个外显子发生突变,机体就无法产生抗肌萎缩蛋白,进而导致肌肉缓慢地断裂和退化。基于该机制,Gersbach教授研究团队开发了一种基于CRISPR的基因疗法(AAV为载体)。该疗法是利用CRISPR/Cas9切断抗肌萎缩蛋白外显子周围发生突变的基因,再利用人体的自然DNA修复系统将剩下的基因重新“缝合”在一起,从而产生一个缩短的、具有正常功能的抗肌萎缩蛋白编码基因。
在动物模型试验中,研究团队选用了成年和新出生的DMD小鼠模型。研究人员为DMD小鼠模型实施了单剂量静脉注射的上述基因疗法,并进行了追踪。前8周研究结果显示,小鼠的抗肌萎缩蛋白功能得到恢复,肌肉力量增强,表明该基因疗法确实有效。
此前的DMD治疗研究都集中于抗肌萎缩蛋白的短期恢复,通常在治疗后4-8周进行评估。然而,基因编辑会导致永久性的基因改变,所以探索该基因疗法可能带来其他后果,以及疗效的持久性至关重要。在接下来的一年中,研究人员对注入小鼠体内的CRISPR系统编辑效果进行了检测跟踪。令人惊喜的是,研究结果表明,该疗法不仅成功编辑了小鼠体内的缺陷基因,并使其获得了长期表达抗肌萎缩蛋白的能力,所有的老鼠在治疗一年后都表现良好!
除了疗效,基因编辑的脱靶问题也非常惹人关注。为了全面研究该基因疗法产生的所有基因编辑事件,研究团队采用了一种DNA测序方法,该方法可报告任何基因编辑类型。研究发现,除了预期的目标外显子外,还有许多种其他编辑类型,包括来自CRISPR/Cas9系统病毒载体的高水平DNA序列插入。
经过对组织类型和CRISPR输送剂量进行分析,研究人员发现,多达一半的基因编辑会导致这些脱靶效应。虽然该结果令人惊讶,但目前的研究数据显示,这些非预期的DNA序列变化并不会影响该基因疗法对DMD的治疗效果和安全性。虽然如此,研究人员表示,任何非预期的基因编辑结果都有潜在的价值,这些基因编辑事件在未来研究的方法设计、识别和减少脱靶效应中都有重要作用。
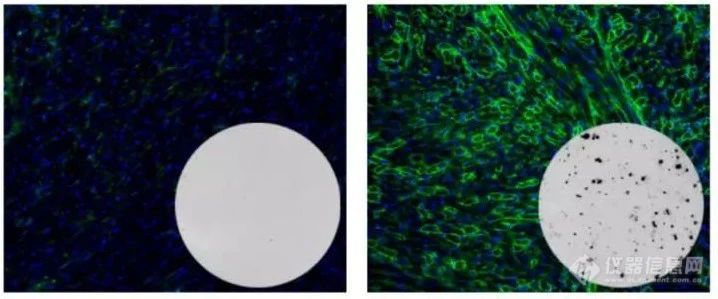
图:未治疗DMD小鼠模型(左)和使用该基因疗法治疗一年后的DMD小鼠模型(右)。绿色表示抗肌萎缩蛋白基因表达水平较高,黑斑表示来自小鼠的T细胞响应细菌Cas9蛋白,表明存在免疫反应。
此外,已有研究表明小鼠的免疫系统可对Cas9产生反应,这可能干扰CRISPR的编辑效果。为此,研究团队还监测了小鼠模型对Cas9蛋白产生的所有免疫反应。研究人员在成年小鼠模型中观察到了抗体和T细胞对Cas9的反应,但这些免疫反应似乎都没有在小鼠体内产生任何毒性,且没有影响治疗效果;新出生的小鼠模型则没有类似的免疫反应。同时,研究人员也在开发新的策略来限制Cas9的表达或在短时间内仅将CRISPR/Cas9系统输送到肌肉细胞,以减少可能的免疫反应。


与该研究同期发表的还有另外两篇文章,都是针对早衰综合征(HGPS)的基因治疗展开,文章题目分别为“Development of a CRISPR/Cas9-based therapy for Hutchinson–Gilford progeria syndrome”和“Single-dose CRISPR–Cas9 therapy extends lifespan of mice with Hutchinson–Gilford progeria syndrome”。前一项研究由西班牙和英国科学家合作完成,后一项由美国索尔克生物研究所科学家领导完成。
HGPS是由LMNA基因点突变引起的一种罕见致死性遗传病。该病的患者自童年开始就快速地衰老,目前还没有针对HGPS的有效治疗。已有研究发现,Lamin A蛋白的编码基因LMNA的突变,促使机体产生了孕激素有毒异构体,这是HGPS的主要致病原因。
在西班牙科学家领导的研究中,研究人员探讨了一种基于CRISPR/Cas9基因疗法的有效性,该方法通过在LMNA基因中引入移码突变,阻断Lamin A蛋白和孕激素的积累,来恢复HGPS引起的细胞成分的变化。研究结果显示,该基因疗法可广泛地改善HGPS小鼠的表型,并延长寿命。
在由美国科学家领导的最新研究中,研究人员通过单剂量全身性注射AAV病毒介导的CRISPR/Cas9组分,来降低小鼠模型中的Lamin A蛋白/孕激素水平,以抑制HGPS的发生。研究结果显示,该基因疗法改善了HGPS小鼠的健康状况,并延长了小鼠的寿命。以上两项研究均展示了CRISPR/Cas9在HGPS小鼠模型中的治疗效果,也为在其他目前无法治愈的罕见疾病中使用CRISPR/Cas9开辟了道路。
基因疗法已经引起了各国科学家和跨国制药巨头的关注。2018年12月1日,美国FDA已经接受Editas Medicine公司为EDIT-101递交的IND申请,允许该公司开展使用CRISPR基因编辑手段治疗Leber先天性黑朦10型患者(LCA10)的临床试验。EDIT-101有望成为世界上第一款在人体内使用的CRISPR疗法。此外,还有多项针对艾滋病、血友病、地中海贫血、心血管病、肾病、肺病等疾病的基因疗法研究正在进行,部分已进入临床试验阶段。希望随着科学技术的进步,更多安全有效的基因疗法能够开发出来,为推进科学和人类健康进步贡献力量。
参考资料:
1. Long-term evaluation of AAV-CRISPR genome editing for Duchenne muscular dystrophy
2. Single CRISPR treatment provides long-term benefits in mice
3. Development of a CRISPR/Cas9-based therapy for Hutchinson–Gilford progeria syndrome
4. Single-dose CRISPR–Cas9 therapy extends lifespan of mice with Hutchinson–Gilford progeria syndrome



 关注微信公众号
关注微信公众号